药物Ⅱ期、Ⅲ期临床试验的工作流程
Ⅱ期、Ⅲ期临床试验的目的是:①证实药物的疗效与安全性;②与常规疗法比较新药的优点和缺点;③在部分病例中进行药代动力学研究,确定治疗剂量范围。
药物Ⅱ期、Ⅲ期临床试验的技术要求和管理规范基本相同。临床试验总体分为三个阶段,临床试验准备阶段、临床试验进行阶段、临床试验结束后,各阶段基本工作程序参考附件1~附件3。
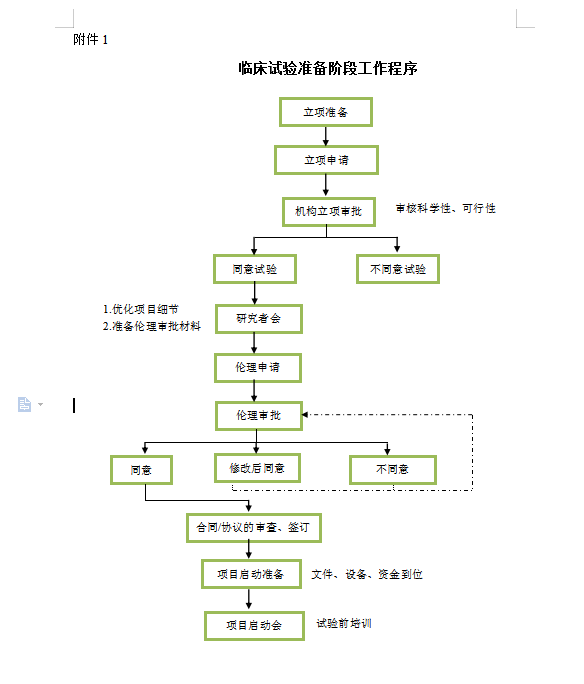
1. 临床试验准备阶段。
(1)获得药政管理部门(国家药品监督管理局)批文或默示许可证明材料、药检部门签发的药品质量检验报告。
(2)准备临床前试验有关资料(综述资料、药学资料、药理学和毒理学资料等),研究者手册、临床试验方案初稿及其他有关资料。
(3)筛选参加临床试验的单位及主要研究者。
(4)各研究单位及申办者对临床试验方案进行讨论并修订。
(5)申办者与研究者讨论并签署临床试验方案。
(6)有关文件(临床试验批文、药品质量检验报告、临床试验方案等)送伦理委会审查,获得伦理委员会的书面批准文件。
(7)研究者与申办方签订合同。
(8)由申办者指定监查员,各研究单位记录监查员的信息及联系方式、以便在临床研究过程中与监查员交流信息。
(9)设计并准备临床试验中所需的各种文件和记录表格。
(10)试验药物的准备:分发、验收、贮存、登记等。
(11)准备好试验场所有必需的医疗设备、急救药品和措施。
(12)由组长单位主持召开临床试验协调会(申办者、组长单位及参加试验单位的主要研究人员和监查员参加),讨论临床试验方案,并分配药品、试剂,有关资料和记录表格。
(13)研究中心召开临床试验项目启动会,对参与研究的人员进行培训。
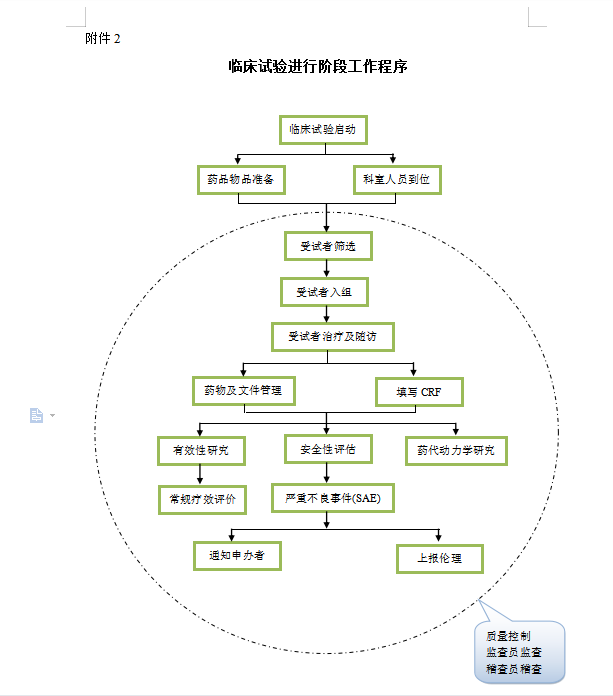
2. 临床试验进行阶段。
(1)招募受试者,参与试验的受试者签署知情同意书,筛选受试者。
(2)按试验方案规定的标准入选病例。
(3)检查急救设备和急救药品,确保其处于可用状态。
(4)按规定的流程进行临床试验,包括各项检查。逐日(住院病例)或按规定时间(门诊病例)填写病例记录文件。
(5)监查员与参加临床试验单位密切联系,做好数据核对及其他联系工作,并与研究者保持经常联系。
(6)主要研究者与项目各参加单位保持密切联系,掌握临床试验进度,协助解决试验中的各种问题,并做好记录。
(7)对于方案中规定的特殊检查项目,各参加单位应及时将标本送至指定单位检测。
(8)临床试验进程中申办者应及时提供有关临床试验新的信息资料,研究者根据情况及时通报有关参加人员。
(9)临床试验进程中如对试验方案、知情同意书,或向受试者提供的信息资料有新的修改补充时,均应报伦理委员会审查,并获书面同意。
(10)试验中研究人员不得随意进行调整和变动,如有变动应报告主要研究者和申办方。
(11)临床试验过程中如药政管理部门对有关法规有修改补充意见时,应及时对试验方案作相应修改,并向伦理委员会报告。
(12)试验过程中试验药物的使用应处于严格的控制中,药物的使用情况应有明确的记录。
(13)发生严重不良事件时,应在规定的时间内报告主要研究者、申办者和伦理委员会,及时给予受试者救治和适当的医疗处理,并做好记录。
(14)进行中期小结及评估,如发现问题需对试验方案进行修改或调整时,应送交伦理委员会审批后执行。
(15)试验中按期召开临床试验协作会议。
(16)研究者应随时准备接受来自申办方和药政管理部门的检查。
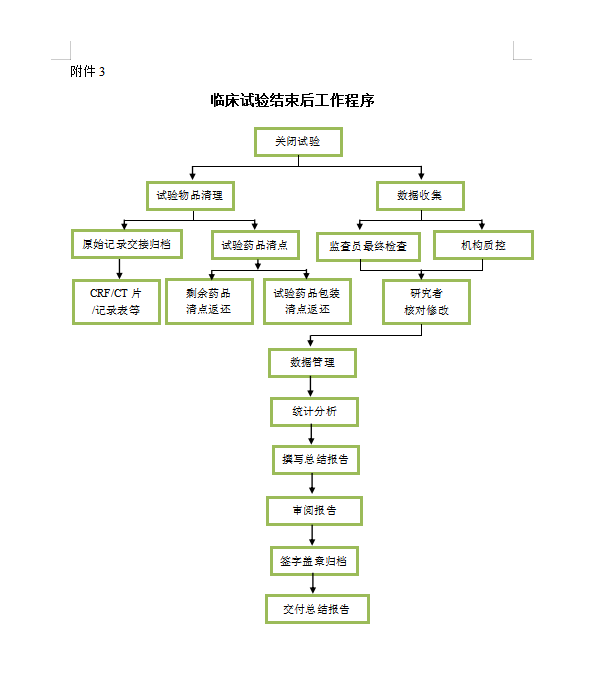
3. 临床试验结束后。
(1)由组长单位通知各参加单位终止临床试验的时间。
(2)收齐所有资料,按试验方案中的规定进行统计、分析。
(3)试验按规定程序破盲。
(4)各参加单位应做好各自的分中心总结。
附件
附件1:临床试验准备阶段工作程序
附件2:临床试验进行阶段工作程序
附件3:临床试验结束后工作程序